

如何建立帕拉米韦质量标准,现在百度检索:
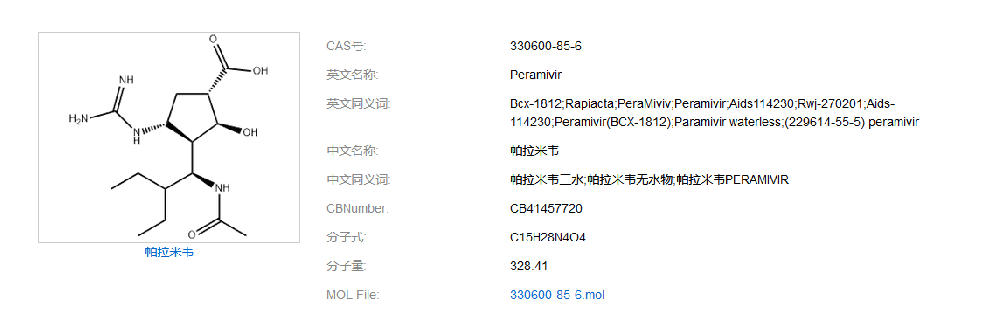
同时在药物在线(https://www.drugfuture.com/standard/):各国药典均未收录载帕拉米韦。无药典收载、无进口标准:

医学百科(https://www.yixue.com):帕拉米韦水合物是美国BioCryst 公司开发的以流感病毒表面糖蛋白神经氨酸酶为作用靶点的新型环戊烷类抗流感病毒制剂,是世界首个静脉给药制剂

EMA审评报告(https://www.ema.europa.eu/en):EMA官网,在搜索框输入商品名:Rapivab

第一条搜索结果就是RLD审核报告
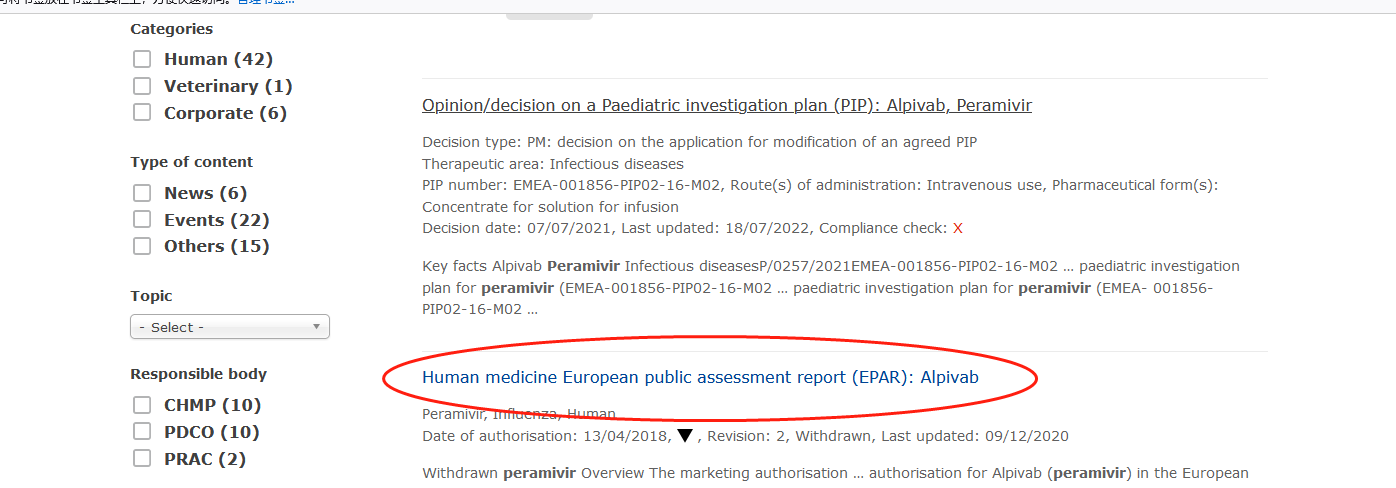
审核报告的命名通常是(见下图)Publicassessment report,或Scientific discussion
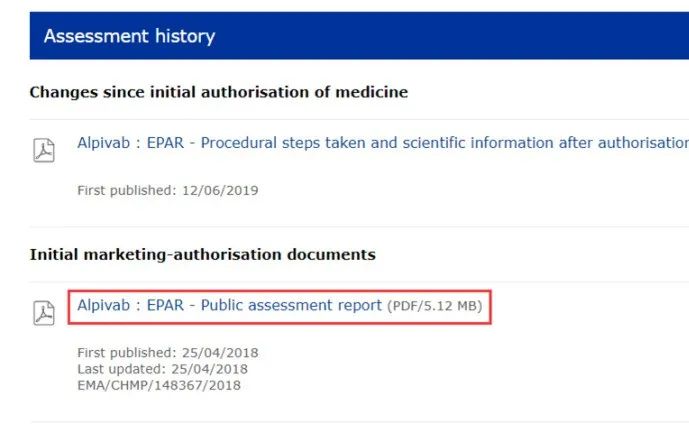
FDA审评报告(https://www.accessdata.fda.gov/scripts/cder/daf/):

选择Rapivab,laber下载RLD说明书,点Review跳转至下载审核报告界面

Chemistry Review可获得RLD的检验报告
PMDA审评报告()
英文转日文的网站
https://www.kegg.jp/dbget-bin/www_bget?dr_ja:D03829
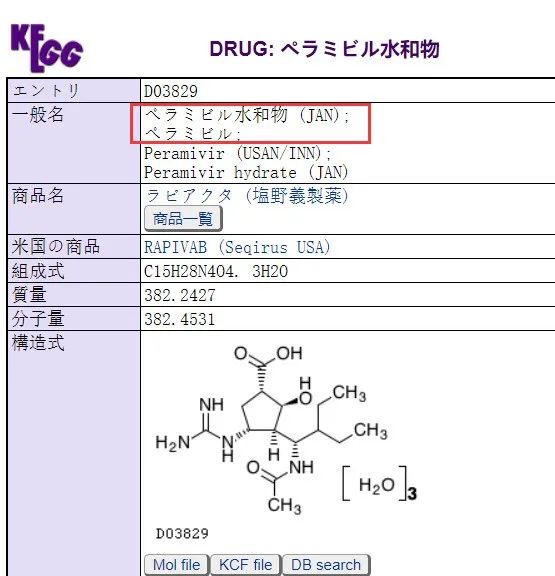
日本说明书和审评报告官网,必须用日文搜索
https://www.pmda.go.jp/PmdaSearch/iyakuSearch/
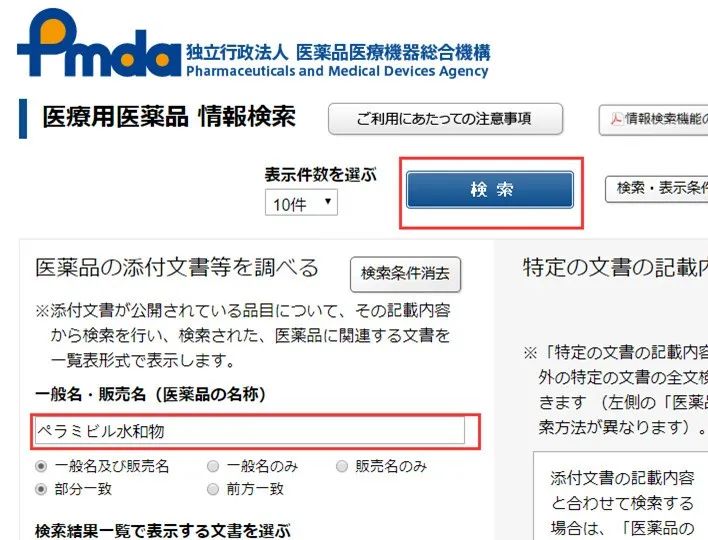
IF文件就是审评报告:

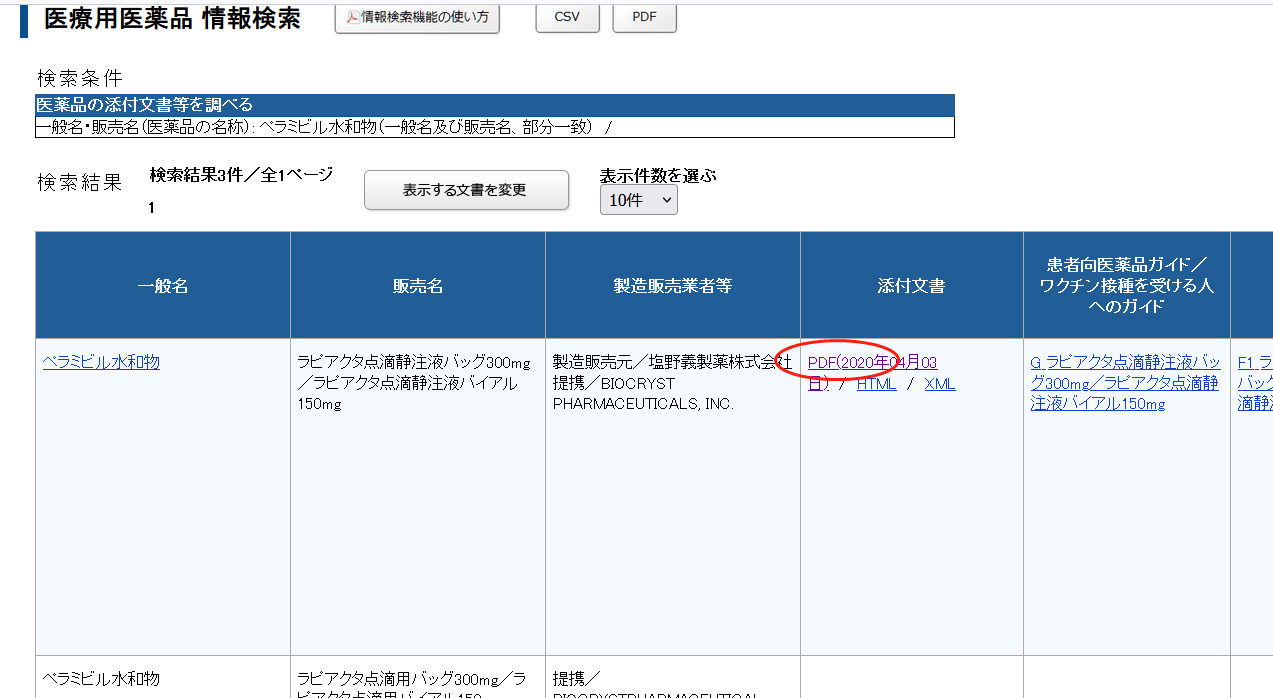

质量标准小结
EMA与FDA的检测项目基本一致:性状,鉴别,含量,有关物质,pH,无菌,细菌内毒素,不溶性微粒,可提取体积,摩尔渗透压
细菌内毒素限度制订
注射时间15-30min
最大日剂量600mg
细菌内毒素:5/[600/(60×1)]=0.5EU/mg,计算过程略

注射液异构体限度制订
参考CDE电子刊物,无安全性相关报道,异构体限度为0.5%

有关物质限度制订-参考ICH Q3
最大日剂量600mg
报告限:0.1%
鉴定限:0.2% or( 2mg/600mg = 0.33%),取最小者
总杂限度:参考RLD近效期,API总杂,或者类似药物的总杂(如扎那米韦原料药EP总杂为1.2%)

帕拉米韦注射液标准制订
性状:无色澄明液体
HPLC/IR鉴别:略
含量:95.0%-105.0%(需要进一步关注是否存在过量灌装)
异构体:0.5%(参考依据:CDE刊物)
pH:5.5-8.5(参考RLD说明书,浓度10mg/ml)
摩尔渗透压:290-350mOsm/kg(参考RLD说明书,浓度10mg/ml ,稀释剂为氯化钠)
细菌内毒素:0.5EU/mg(参照中国药典计算)
无菌、不溶性微粒、装量:应符合现行药典
有关物质:报告限为0.1%,鉴定限为0.2%,总杂待定
帕拉米韦(原料药)标准制订
PH值:5.5-8.5(说明书:溶剂为氯化钠溶液,浓度10mg/ml)
溶液的澄清度与颜色:澄清无色(说明书:溶剂为氯化钠溶液,浓度10mg/ml)
残留溶剂:限度参考ICH Q3C
元素杂质:限度参考ICH Q3D
重金属:10ppm(欧洲药典质量标准的起草技术指南)
微生物限度:现行中国药典
有关物质、含量、水分:参考厂家标准
细菌内毒素:0.441EU/mg(考虑辅料的累加计算获得)
稳定性
PMDA:光照稳定

加速40度/75%RH:6个月
长期25度/60%RH:60个月
需要考虑30度的条件吗

对照品及杂质检索
USP检索 https://www.usp.org/
EP检索 https://crs.edqm.eu/index.html
中检院http://aoc.nifdc.org.cn/sell/home/search.html
TRC检索https://www.trc-canada.com/
TLC检索 http://tlcstandards.com/Home.aspx
LGC检索https://us.lgcstandards.com/CA/en/
免责声明:本站提供的一切文章和内容信息仅限用于学习和研究目的;不得将上述内容用于商业或者非法用途,否则,一切后果请用户自负。本站信息来自网络收集整理,版权争议与本站无关。我们非常重视版权问题,如有侵权请邮件与我们联系处理。敬请谅解!
本文最后更新于2022-08-25 19:34:52,如果你的问题还没有解决,可以加入交流群和群友们一起讨论。